
时间:2022-08-06 12:01:06来源:网络整理
分子结构和性质(综述).ppt
上传者:w** 文档ID:835619 上传时间:2020-01-15 格式:PPT 页数:25 大小:671.50KB
第二章分子结构与性质主要知识点复习 S-S Overlaps S-P Overlaps P-P Overlaps1.σ键合方式“头对头”一、共价键合原子共享电子对形成的相互作用称为共价键。
2.p-pπ键的形成过程“并排”二、键参数1.键能 气态基态原子形成1mol共价键(或分解1mol共价键)价键吸收的能量),例如H-H键的键能为436.0kJ.mol-1,键能可以作为键参数来衡量化学键的牢固性。
2.键长是形成共价键的两个原子核之间的平衡距离。
密钥能量与密钥长度的关系:
一般来说,键长越短,键能越大,分子越稳定。3.一个键角分子中两个相邻共价键之间的夹角称为键角。
键角决定了分子的三维结构和分子的极性。三、等电子学原理1.原子总数相同和原子总数相同的分子价电子具有相似的化学键特性,许多性质相似。
这个原理叫做等电子原理2.等电子的判断和使用方法:
具有相同原子总数和相同价电子总数的分子使用等电子学:
利用等电子的相似性质和相同的空间构型,可以用来预测分子空间的构型和性质四、价壳电子对排斥模型(VSEPR)ABn型分子的基点(ion) 中心原子A周围的价电子对的几何构型主要取决于价电子对数(n)。价电子对应尽可能远离,以尽量减少它们之间的排斥。
平面三角形1200正四面体109.50MMM直线1800价电子对空间构型432n直线平面三角形四面体BeCl2、HgCl2BF3、BCl3(CH4、CCl4、NH4+)中心原子价电子均用于形成共价键不存在孤对电子三角锥V型H2O,H2S(NH3;H3O+)中心原子有孤对电子CH4:
(sp3杂化)激发杂化3sp3spp2s2s2p2s2C:
2p五、混合轨道理论SP3 Hybrid SP2 Hybrid SP2 Hybrid2.混合轨道的应用范围:
混合轨道只能用于形成 σ 键或容纳不参与键合的孤对电子。
确定下列分子或离子中中心原子杂化轨道类型的通用方法:NH4+、NH3、H2O、CH2O、SO2BeCl2、CO2:
1、检查中心原子是否形成双键或三键。如果有1个三键,则有2个π键,使用2个P轨道,形成SP杂化;如果有1个双键,就有1个π键,形成SP2杂化;如果都是单键,则形成SP3杂合体。
2、未充满电子的空轨道一般不参与杂化,一对孤电子占据一个杂化轨道。
金属原子与中性分子或阴离子配位键形成的络合物称为络合物原子结构和性质,其中:
金属原子为中心原子,中性分子或阴离子(如H2O、NH3、Cl-)称为配体。
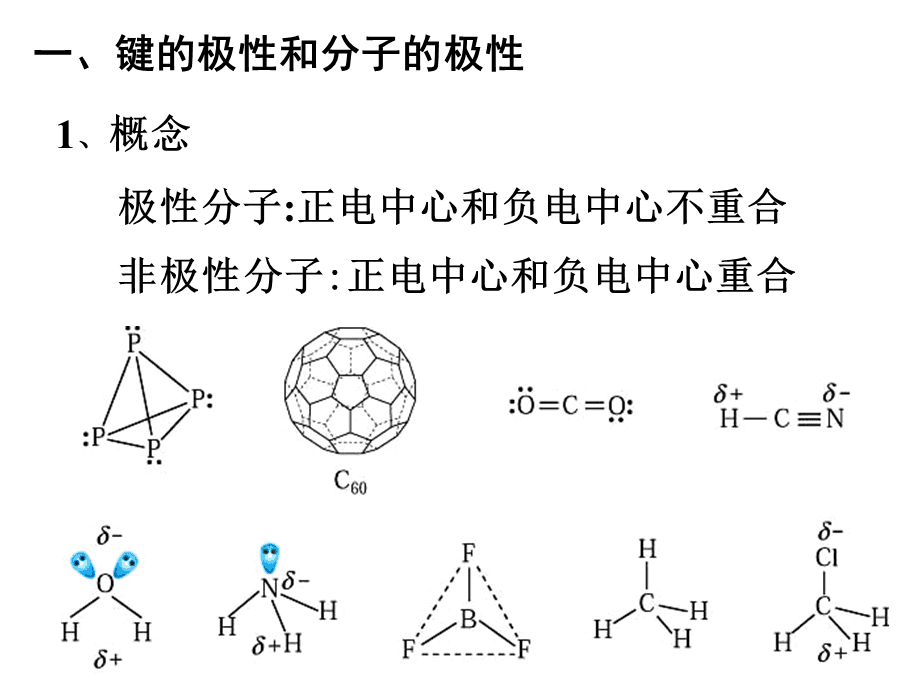
六、配位化合物 理论例子 H2HCl 特征组成 原子对电子对的吸引力 共享电子对的能力 位置键合原子 电 结论(键的性质) 同种原子相同,不利于任何一个原子,都不带电 A:
A 不同种类原子的非极性键对吸引电子能力强的原子有不同的偏好。主导电荷A:
双极性键七、非极性键和极性键分类非极性分子极性分子定义共享电子对对称分布对称H2、Cl2CO2、CS2 不均匀电荷分布不对称分子偏移或不对称分布不对称不对称HCl , H2ONH3八、极性分子和非极性分子方法总结1.完全由非极性键组成的分子一定是非极性分子。
2.由极性键组成的双原子分子一定是极性分子。
3.在含有极性键的多原子分子中,如果结构对称,则键的极性被取消,分子为非极性分子。
如果分子结构不对称,键的极性不能完全取消,分子是极性分子。
经验法则:
在ABn型分子中,当A的化合价等于其族数时,该分子为非极性分子。分子极性的判断分子间作用力对物质的熔点和沸点、溶解度等性质有直接影响影响九、范德华力和氢键对物质性质的影响分子间作用力氢键范德华尔斯力 分子间氢键 分子内氢键 相对分子质量 分子极性分子 指与氧、氮、氟结合的氢原子与另一个分子中电负性最大的原子之间的力。
通常用X—H…Y表示,式中虚线表示氢键。
X、Y代表电负性大、原子半径小的原子,如F、O、N等。
2.氢键形成条件
(1)分子必须有一个氢原子,它与电负性最强的元素原子形成强极性键;
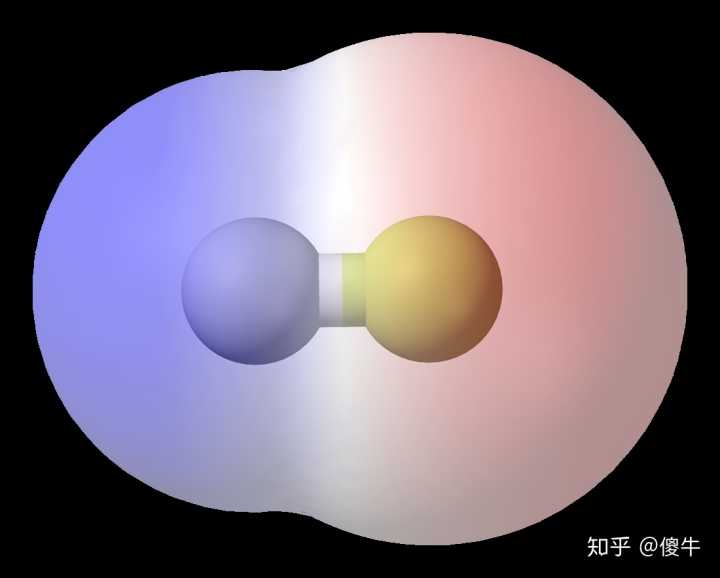
(2)分子必须包含具有孤电子对、大电负性和小原子半径的原子。
实际上,只有F、O、N等原子与H原子结合的物质才能形成强氢键。
3.氢键对化合物性质的影响 当分子间氢键形成时,化合物的熔点和沸点可以显着提高。
在极性溶剂中,如果溶质分子和溶剂分子之间可以形成氢键,则溶解度会增加。
分子内氢键的形成使分子具有环状闭合结构。
一般物质的熔点会降低,在极性溶剂中的溶解度会降低十、溶解度
(一)相似相容原理1.极性溶剂(如水)易溶解极性物质2.非极性溶剂(如苯、汽油、四氯化碳、酒精)等.)能溶解非极性物质(Br2、I2等)3.含有相同官能团的物质是互溶的原子结构和性质,如羟基(-OH)在水中能溶解醇、酚、和含羟基的羧酸。
手性异构体,手性分子,手性原子,手性催化剂,手性合成,十个一、手性分子对,原子的组成和排列完全一样,但它们是互为镜像的左手和右手。在三维空间中,旋转不能以任何方式重叠,这对分子相互称为手性异构体。
具有手性异构体的分子称为手性分子。
中心原子变成手性原子。
10一、无机含氧酸的酸度
(1)对于不同的元素,元素的非金属性越强,其水合物对应的最高价氧化物的酸性越强。
(2)对于相同元素形成的含氧酸(H2O)mROn,n越大,与中心原子R相连的非羟基氧越多,酸性越强。
同一时期的含氧酸,从左到右,酸度随着中心原子的原子序数增加而增加。
同族含氧酸,从上到下,随着中心原子原子序数的增加,酸性减弱。
同一元素的不同化合价的含氧酸的酸度比低的高。
无机含氧酸的强度变化
声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
图文推荐

2022-08-06 11:40:12

2022-08-06 11:40:03

2022-08-06 10:57:18

2022-08-06 09:31:13

2022-08-06 09:31:03

2022-08-06 08:48:13
热点排行
精彩文章

2022-08-06 12:01:06

2022-08-06 12:00:32

2022-08-06 11:40:26

2022-08-06 11:40:06

2022-08-06 11:00:41

2022-08-06 10:57:20
热门推荐
