
时间:2022-05-16 13:58:00来源:
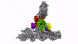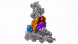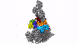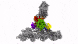
新方法使IST Austria的科学家能够了解细胞的最深处:深度冷冻细胞的高分辨率图像显示了以前只能猜测的结构。
我们体内的细胞正在运动。有些人从A迁移到B以治愈伤口或抵抗病原体。他们在迁移细胞前沿的小“脚”的帮助下做到了这一点,即所谓的lamellipodia。这些细小的延伸部分被向前推动并结合到表面,而其余的单元格则被拉动。在这些脚的内部,有一个密集的交织的蛋白质线网络,称为肌动蛋白丝,形成了细胞的细胞骨架。到目前为止,还不清楚Arp2 / 3复合物是由七种蛋白质组成的,对细胞运动具有重要作用。这种复合物是如何从已有的肌动蛋白丝中萌发的,从而产生致密的分支网络,为细胞提供所需的突出力。
到目前为止,科学家们不得不决定何时要分析Arp2 / 3复合物的结构:一种选择是对其进行单独研究,其中蛋白质复合物处于无活性构象,因此无法理解网络的形成方式。为了被完全激活,Arp2 / 3复合物需要与肌动蛋白丝结合。这就需要使用一种称为电子断层扫描的方法,其代价是分辨率要低得多。“在试管环境中,与肌动蛋白丝结合的Arp2 / 3配合物的先前电子断层扫描数据太不精确,无法明确地指出该配合物的单个元素必须位于何处,”博士后弗洛里安·法斯勒(FlorianFäßler)解释说。 IST奥地利教授Florian Schur小组。
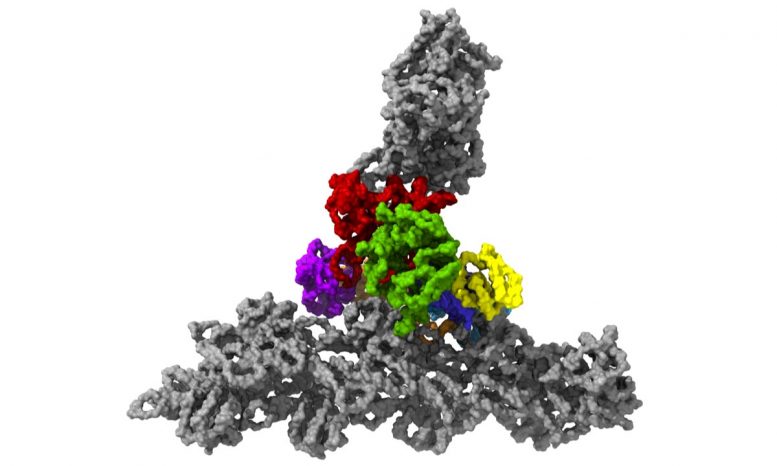
具有七个亚基的蛋白复合物Arp2 / 3(彩色),同时与肌动蛋白丝结合(灰色)。
两年多来,他一直在寻找一种在自然环境中描绘蛋白质复合物的方法,以便可以精确分析其个体结构。现在他已经成功了。他以小鼠肌动蛋白结合的构象对小鼠细胞层状脂质体内的复合物进行了成像。“我们对自己说:好的,我们要进入细胞,那里的环境要复杂得多,因为不仅有蛋白质复合物和肌动蛋白丝,而且还有各种各样的其他东西。但这是我们能够以能够确定其结构的方式维护该网络的唯一方法。”分子生物学家Florian Schur说道。
零下196摄氏度的温度使这成为可能。研究人员在几毫秒内冻结了样品-冻结得太快,以至于无法形成冰晶,而冰晶会破坏细胞的精细结构。然后,他们使用了现有的最强大的低温电子显微镜之一,并且是奥地利唯一的此类显微镜,使用低温电子断层扫描从不同角度对细胞进行成像。为此,研究小组收集了足够的数据,以对处于活动状态的10,000多个Arp2 / 3复合物进行3D重建。然后结合先进的图像处理,他们以小于一纳米的分辨率生成了Arp2 / 3复合物的3D模型。为了进行比较:人的头发大约有50,000纳米厚。“我们现在能够相对精确地描述蛋白质复合物及其亚基的结构,以及它们如何在先前活细胞的层状脂质体内部形成肌动蛋白丝网络,” FlorianFäßler说。“五年前,可能没人会想到可以做到这一点,”舒尔补充道。
由于采用了先进的方法,研究小组可以驳斥一个较早的模型,该模型假定Arp2 / 3复合物和肌动蛋白丝之间的连接面积更大。但是,科学家们证实了该复合物如何调控并形成新的肌动蛋白丝的其他方面。有了这些知识,其他科学家现在可以更好地了解这种重要的蛋白质复合物在细胞运动和疾病发展之外的多种作用中的调控和活性。“我们要做的是在方法和分辨率方面尽可能地利用此类复杂的样本。通过当前的解决方案,我们获得了新的生物学见解,但这也是方法论的进步,可以证明:有可能。”舒尔热情地说道。弗洛里安·法斯勒(FlorianFäßler)现在希望进一步改进该方法,以可视化其他蛋白质,并探索该方法可以使我们看到细胞内部的距离。舒尔说:“我们才刚刚开始认识到冷冻电子断层扫描的全部潜力。”
资金:奥地利科学基金(FWF),乔治·迪姆切夫(Georgi Dimchev),弗洛里安·舒尔(Florian Schur)。
声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
图文推荐
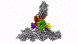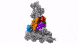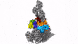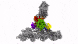
2022-05-16 13:58:00
![认识NASA宇航员和Artemis团队成员Matthew Dominick [视频]](http://www.jjchem.net/uploadfile/2021/0616/2021648423.jpg)
2022-05-16 12:58:04
2022-05-16 11:58:03

2022-05-16 10:58:00
2022-05-16 09:58:01
2022-05-16 09:39:02
热点排行
精彩文章

2022-05-16 12:58:11

2022-05-16 11:58:05

2022-05-16 11:01:08
2022-05-16 11:00:39

2022-05-16 10:58:03

2022-05-16 10:01:28
热门推荐
