
时间:2022-08-30 12:04:57来源:网络整理
掌握制备金属配合物最常用的方法——水溶液中的取代反应和氧化还原反应;利用水溶液的取代反应制备金属配合物是金属盐和水溶液中的化合物。身体之间的反应。事实上,适当的配体用于取代水合络离子中的水分子。氧化还原反应是在配体存在的情况下,适当地氧化或还原不同氧化态的金属配合物,得到金属配合物。 Co(II) 配合物的取代反应很快(活性),而 Co(III) 配合物的取代反应非常慢(惰性)。 Co(III) 配合物通常通过 Co(II)(实际上是其水合配合物)与配体之间的快速反应形成 Co(II) 配合物,然后将其氧化成相应的 Co(III) 配合物(配位数均为六)。常见的Co(III)配合物有:[Co(NH3)6]3+ (黄色), [ Co(NH3)5H2O]3+ (粉红色) ), [Co(NH3)5Cl]2+ (洋红色), [Co(NH3)4CO3] (洋红色), [Co(NH3)3(NO2)@ >3](黄色)、[Co(CN)6](紫色)、[Co(NO2)@>6](黄色)仪器及材料:电子台秤、烧杯、锥形瓶、量筒、研钵、漏斗、铁架、酒精灯、试管(15mL)、滴药液:浓氨水、硝酸(浓)、盐酸(6mol/L,浓)、H2O2(30%)、AgNO3(2mol/L)、 SnCl2(0.5mol/L,新制备)、纳氏试剂、乙醚、戊醇等
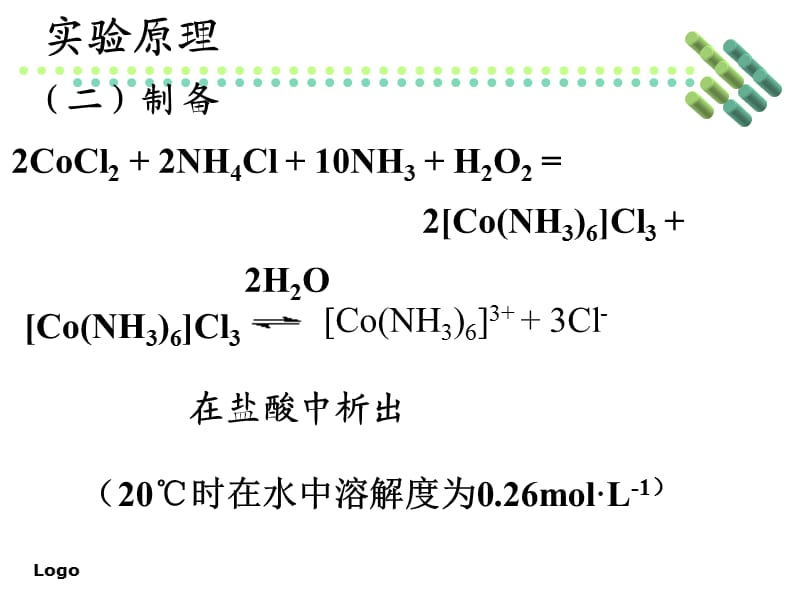
将 1.0g 氯化铵溶解在锥形瓶中的 6mL 浓氨水中。完全溶解后,握住锥形颈连续摇动,使溶液均匀。分次加入2.0g氯化钴粉,边加边摇,加入后继续摇,使溶液呈棕色浆状。然后向其中滴加2-3 mL过氧化氢(30%),边加边摇,加完后摇一摇。待溶液停止冒泡后,缓慢加入 6 mL 浓盐酸,边加边摇,加入酒精。灯管微热,不能加热至沸腾(温度不宜超过85),边摇晃边加热10-15mL冷水洗涤沉淀数次,再用5mLmol/L盐酸洗涤,产品在105左右烘干,称重。+3-3+实验时间:6课时课堂讲授:多媒体讲解演示;学生实验,老师现场指导学生操作。通常二价钴比较稳定,但在氨络合物形成后,由于三价钴和钴氨的稳定常数较大,导致电位变化较大,Co()氨络合物易被氧化成Co()氨络合物。不同的制备条件,Co与氨形成多种配合物,主要包括:三氯化六氨合钴()Co(NH3)6Cl3(橙黄色晶体);五氨合三氯化钴一水合物()[Co(NH3)@ >5H2O]Cl3(砖红色晶体)); mon ochloropentammine 钴二氯化物 () [Co(NH3)5Cl]Cl2 (紫色晶体) 氯化钴氨络合物在空气中被氧化,主要在没有催化剂的情况下生成 紫红色 [Co(NH3) @>5Cl]Cl2,反应式如下。但在催化剂存在下,空气氧化产物为橙黄色[Co(NH3)6]Cl3。
反应式如下。如果催化剂是活性炭,以H2O2为氧化剂,氧化产物也是橙黄色的[Co(NH3)6]Cl3),当没有催化剂活性炭时,往往会发生取代反应,即即六配位胺化合物中的氨分子很容易被其他基团取代得到[Co(NH3)5Cl]Cl2。要确定配合物的组成,一般先确定外界,然后破坏络离子 看内圈,这个实验是初步推论,一定浓度的络合物溶液的电导率可以用电导仪测量,与已知电解质溶液的电导率。氰化钾作用生成蓝色络合物[Co(NCS)4]2-来判断其存在。在NH3-NH4Cl溶液中加入CoCl2的目的是降低OH-浓度,防止Co(OH)2 Pre 的形成沉淀;另一方面,它也为反应提供Cl-。反应首先生成棕色的[Co(NH3)6]Cl2,进一步氧化为[Co(NH3)5Cl]Cl2。本实验未使用催化剂,产物为[Co( NH3)5Cl]Cl2.反应有如下平衡[Co(NH3)5Cl]Cl2=[Co(NH3)5Cl]2++2Cl-,加盐酸可使天平向左移动,缓慢加入盐酸得到大晶体,便于过滤和干燥,2+水浴稍加温,保持10~15分钟,以提高反应速度,保证[Co(NH3)6]是外轨道3+配合物,[Co(NH3)5Cl]是内轨道配合物,从外轨道转变为内轨道会导致速度变慢。继续在室温下冷却缓慢结晶以利于晶体生长,分别用盐酸和乙醇洗涤,沥干水浴干燥。
不要高温干燥二氯化一氯五氨合钴,否则[Co(NH3)5Cl]Cl2可能被还原为CoCl2;3+3.加入SnCl2还原Co,加入硫氰酸钾形成蓝色络合物[ Co(NCS)4]2-.5.溶液加热,络合物被破坏,最后Co变成Co2O3nH2O,一种氧化钴的水合物,上课1小时,原理是40分钟,电导仪的使用演示20分钟,学生实验时间约为4-5课时,水浴稍微加热,保持10-15分钟,保证反应完成。最后加入7mL浓盐酸,借助同离子效应使产物沉淀。《化学实验规范》北京师范大学主编北京师范大学出版社实验组:第九实验班:应131- 1 掌握碘量法测定样品中钴含量的原理和方法方法。了解电导法确定产物解离型的原理和方法 培训无机合成和滴定分析的基本操作,掌握确定成分和化学式的原理和方法。 [Co(NH3)6]Cl3是抗磁性的,低自旋钴()在阳离子八面体的中心由于阳离子符合18电子规则,被认为是典型的例子一种对配体交换反应呈惰性的金属配合物。作为其对配体交换反应惰性的一个体现,[Co(NH3)6] Cl3NH3 与中心原子 Co() 的配位非常紧密,NH3 不会在酸溶液中不解离质子化,使浓盐酸中可回收[Co(NH3)6]Cl3。有结晶析出。
相反,一些不稳定的金属氨络合物如[Ni(NH3)6]Cl2、Ni()-NH3是不稳定的,所以[Ni(NH3)6]Cl2)遇酸分解,六氨合三氯化钴受热会失去部分氨分子配体,形成强氧化剂,六氨合三氯化钴中的氯离子可被硝酸根、溴离子和碘离子等一系列其他阴离子交换生成相应的[Co(NH3)6]X3衍生物。这些配合物呈亮黄色,显示出不同程度的水溶性。Cobalt()Cl()氨配合物的种类很多,主要是六氨合三氯化钴(),[ Co(NH3)6]Cl3橙黄色晶体;五氨合三氯化钴([Co(NH3)5(H2O)]Cl3,砖红色晶体;氯五氨合钴()二氯化物,[Co( NH3)5Cl]Cl2、紫红色晶体等,它们的制备条件各不相同,以活性炭为催化剂时,主要生成六氨合三氯化钴();无活性炭时,主要生成氯五氨合二氯化钴。电子在八面体场中很低。自旋排列仍然是高自旋排列。在可见光区,可以从复合离子(吸光度-波长)曲线上能量最低的吸收峰对应的波长λ获得分裂能量Δ。以氢氧化物的形式析出,洗涤后用HCl还原成二价钴,蒸发浓缩后可回收氯化钴。2.1络合物合成原理六氨合三氯化钴化学式为[Co( NH3)6]Cl3,橙黄色结晶,20在水中的溶解度为0.26molL-1。

钴的性质:Co3+为三价正离子,在酸性溶液中为d2sp3,Co3+具有强氧化性,容易被多种还原剂氧化还原[Co(NH3)6]3 + 离子非常强稳定,其K(稳定)=1.61035,所以在强碱(冷)或强酸作用下基本不分解,只有加入强碱在12NH3+实验以活性炭为催化剂,在氨和氯化铵存在下,通过氯化钴溶液的过氧化氢氧化制备六氨合三氯化钴( )。H2O2====2[Co(NH3)@ >6]Cl3(橙色)+14H2O(Co3+/Co2+)=1.84V,所以一般来说,Co()在水溶液中是稳定的,不易氧化成Co(),反之,Co( ) ) 很不稳定,很容易氧化水放出氧气φ(O2/H2O)=1.229V。但在络合剂氨水存在下,由于形成对应配合物[Co(NH3)6] 2+, 电极电位φ [Co(NH3)6]3+/[Co(NH3)6]2+=0.1 V,所以CO()很容易被氧化作为Co(),得到更稳定的Co()配合物。 2.2NH3 测定原理。因为六氨合三氯化钴在强酸和强碱(冷)作用下基本不分解,只有在沸腾热的条件下才被强碱分解。因此,在样品溶液中加入NaOH溶液,加热至沸腾,分解六氨合三氯化钴,蒸出氨气。

蒸馏后的氨用过量的2%硼酸溶液吸收,以甲基橙为指示剂,用HCl标准溶液滴定生成的硼酸氨,计算氨的百分比。 +6NH3++6 NaCl NH3+H3BO3 NH4H2BO3 NH4H2BO3 2.3 钴的测定原理 钴离子氧化,钴含量采用经典法测定 [Co(NH3)6]Cl3 +6NH3 ++6 NaCl Co(OH)3+3HCl==== Co3++3 H2O Co3++2I-====2Co2++I2 I2+2 S2O32- Er法是在中性或弱溶液中滴定Clˉ含Clˉ的碱性溶液用K2CrO4指示剂和AgNO3标准溶液,由于AgCl的溶解度小于AgCrO4的溶解度,根据逐步沉淀的原理二氯化一氯五氨合钴,在溶液中实现AgCl白色沉淀。 AgCl完全,稍微过量的Ag+和CrO4-会形成砖红色的Ag2CrO4沉淀,从而表明该位点的到来。终点前:Ag++Cl-=AgCl(white) Ksp=1. 810-10 2.5[Co(NH3)6]Cl3晶体场理论决定了配合物的颜色原理。轨道被th的负电场以不同程度的斥力分裂e 周围的配体 NH3, dx2-y2, dz2 轨道 dxy,dxz,dyz 的能量上升低于前两个轨道的上升。
晶体场论可以解释配合物的颜色。由于 Co 的 3d 轨道没有被填满,在 NH3 的作用下发生轨道分裂。当Co3+在可见光区吸收一定波长的光时,会发生d-d跃迁,需要吸收E=hc/in的分裂能。 4)用分光光度计测量一定范围内不同波长处对应的吸光度,绘制曲线得到最大吸光度处对应的波长。配合物呈现的颜色是最大吸收光的补色。实验仪器和药品3.1 实验仪器 铁架、温度计、药勺、玻璃棒、漏斗、滴管、移液管、洗瓶、手表玻璃、容量瓶、酸滴定管、碱性滴定管、量筒、称量瓶、烧杯、试剂瓶、滴瓶、锥形瓶、碘瓶、烘箱、吸滤瓶、布氏漏斗、真空泵、恒温水浴、冰箱、研钵、干燥器、分析天平、通用电子天平、电导仪、分光光度计、凯氏定氮仪氮分析仪。 3.2 供试药物浓氨水、5%H2O2)0@>浓盐酸、CoCl26H2O、95%乙醇、NH4Cl固体、2%硼酸溶液、活性炭、10%NaOH溶液、95%乙醇、KI固体、Na2S2O3.5H2O晶体、AgNO3溶液(校准)、无水碳酸钠固体、2%淀粉溶液、甲基红溴甲酚氯化物指示剂。 2)2@>1[Co(NH3)6]Cl3的制备 称取2)4@>4mL去离子水于锥形瓶中的10mL量筒中,称量3.加入95g NH4Cl至用电炉加热锥形瓶加速溶解,用电子天平称量2)6@>05g CoCl2?6H2O晶体溶解后放入锥形瓶中,用电子天平称量2)6@ > @0.在锥形瓶中加入43g活性炭使其完全溶解。
将锥形瓶放入冷水中冷却至5℃左右,用25mL量筒量取13.5mL浓氨水加入锥形瓶中,然后将锥形瓶放入冷水中再次冷却后用 10mL 称取质量分数为 30%的 H2O2 3mL 于带规格量筒的 100mL 烧杯中,再用 25mL 量筒向烧杯中加入 15mL 去离子水。用玻璃棒搅拌均匀,得到质量分数为 5% 的 H2O2。另外,用25mL量筒量取13.5mL质量分数为5%的H2O2,用橡皮头滴管将量筒中的液体缓慢滴入锥形瓶中。摇动锥形瓶,滴加完毕后,让中间的锥形瓶静置5 min。打开水浴,调节温度至60℃,待温度升至55℃后,将锥形瓶放入水浴中加热,连续摇动锥形瓶20min。完成后,将锥形瓶放入冷水中冷却至6℃,减压过滤,用抽滤后的母液冲洗锥形瓶。在 250mL 烧杯中加入三分之一的去离子水,用电炉加热至沸腾。用100mL烧杯量取50mL沸水,在0mL沸水中搅拌吸滤器,用5mL量筒量出1.7mL 烧杯中加入浓盐酸,搅拌均匀。烧杯在电加热炉上加热,趁热抽滤(烧杯需用滤液冲洗3次,抽滤),将所得滤液转移至锥形瓶中,置10mL量筒中2)6@>使用7mL浓盐酸,用塑料尖头滴管将浓盐酸缓慢加入锥形瓶中,不断摇动。加入溶液后,静置 5 分钟。
将锥形瓶放入冷水中冷却,用5mL量筒在小烧杯中量取1mL浓盐酸和5mL去离子水,充分混匀,得到2mol/L盐酸溶液,用5mL量筒量取 2mL 2mol/L 盐酸溶液,再用10mL 量筒称取5mL 无水乙醇。当锥形瓶中溶液冷却至6℃时,抽滤。抽滤过程中,先用抽滤后的母液洗涤锥形瓶3次,抽滤,然后将2 mL 2 mol/L的盐酸溶液倒入滤饼中。再次洗涤吸滤,最后将滴管的无水乙醇均匀倒入滤饼中洗涤吸滤一次(洗涤两次加溶液时吸滤机不工作。取一块干净的表玻璃,称重得m table = 22)6@>51g,将滤饼转移到蒸发皿中,用水蒸气干燥样品,待样品干燥后称重,得mtotal=31. 75g,所以得到最终m产品=mtotal-mtable=5.24g.10)用电子分析天平取0.1013g样品,加超纯水到烧杯中溶解转移到250ml容量瓶中,定容。测量其电导率k=531us/cm 2)2@>2氨的测定2)2@>2.1盐酸溶液的制备与校准4.2.1.1 盐酸溶液的制备(已制备,标签显示为0.2mol/L,需自行校准)2) 2@>2.1.2无水碳酸钠标准溶液(参比溶液)的制备用电子分析天平称取无水碳酸钠2.9544g和100ml烧杯,href=""目标="_blank" class="keylink">KEDO
声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
图文推荐

2022-08-30 12:04:57

2022-08-30 10:57:44

2022-08-30 08:05:23

2022-08-29 12:23:13

2022-08-29 11:40:04

2022-08-29 10:57:12
热点排行
精彩文章

2022-08-30 11:40:05

2022-08-30 10:57:46

2022-08-30 10:14:27

2022-08-30 10:14:16

2022-08-30 09:31:18

2022-08-30 08:48:05
热门推荐
